
Gebrauchsinformationen: Informationen für Anwender
FIBRYGA 1 g Pulver und Lösungsmittel zur Herstellung einer Injektions-/Infusionslösung
Humanes Fibrinogen
Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen, denn sie enthält wichtige Informationen.
- Heben Sie die Packungsbeilage auf. Vielleicht möchten Sie diese später nochmals lesen.
- Wenn Sie weitere Fragen haben, wenden Sie sich an Ihren Arzt oder Apotheker.
- Dieses Arzneimittel wurde Ihnen persönlich verschrieben. Geben Sie es nicht an Dritte weiter. Es kann anderen Menschen schaden, auch wenn diese die gleichen Beschwerden haben wie Sie.
- Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt oder Apotheker. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind. Siehe Abschnitt 4.
Was in dieser Packungsbeilage steht
1. Was ist FIBRYGA und wofür wird es angewendet?
Was ist FIBRYGA?
FIBRYGA enthält das Eiweiß Fibrinogen vom Menschen, das ein wichtiger Bestandteil der Blutgerinnung (Koagulation) ist. Bei einem Mangel an Fibrinogen gerinnt das Blut nicht so gut wie es soll, was eine erhöhte Blutungsneigung zur Folge hat. Der Ersatz des humanen Fibrinogens durch FIBRYGA behebt die Gerinnungsstörung.
Wofür wird FIBRYGA angewendet?
FIBRYGA wird angewendet zur:
- Behandlung von Blutungsepisoden und als Prophylaxe für chirurgische Eingriffe bei Patienten mit angeborenem Fibrinogenmangel (Hypo- oder Afibrinogenämie) mit Blutungsneigung.
- Fibrinogensupplementierung bei Patienten mit unkontrollierten schwerwiegenden Blutungen, begleitet von einem erworbenen Mangel an Fibrinogen während eines chirurgischen Eingriffs.
2. Was sollten Sie vor der Anwendung von FIBRYGA beachten?
FIBRYGA darf NICHT angewendet werden,
- wenn Sie allergisch gegen humanes Fibrinogen oder einen der in Abschnitt 6. genannten sonstigenBestandteile dieses Arzneimittels sind.
- wenn Sie in der Vergangenheit allergische Reaktionen auf FIBRYGA gezeigt haben.
Bitte informieren Sie Ihren Arzt, wenn Sie allergisch gegen ein Arzneimittel sind.
Warnhinweise und Vorsichtsmaßnahmen
Bitte sprechen Sie mit Ihrem Arzt oder Apotheker, bevor Sie FIBRYGA anwenden.
Risiko für Blutgerinnsel in Blutgefäßen
Ihr Arzt sollte den Nutzen dieses Arzneimittels gegen das Risiko von Blutgerinnseln in Blutgefäßen abwägen, insbesondere:
- wenn Sie dieses Arzneimittel in hohen Dosen oder mehrfach erhalten haben.
- wenn Sie einen Herzanfall hatten (koronare Herzerkrankung oder Myokardinfarkt in der Vorgeschichte).
- wenn Sie eine Lebererkrankung haben.
- wenn Sie gerade eine Operation hatten (postoperative Patienten).
- wenn Sie demnächst eine Operation haben werden (perioperative Patienten).
- bei neugeborenen Säuglingen (Neugeborene).
- wenn es bei Ihnen voraussichtlich zu Blutgerinnseln oder Gerinnungsstörungen in den Blutgefäßen kommen wird (Patienten unter Risiko für thromboembolische Ereignisse oder disseminierte intravaskuläre Gerinnung).
Ihr Arzt wird bei Ihnen möglicherweise zusätzliche Tests zur Blutgerinnung durchführen, um dieses Risiko zu überwachen.
Allergische oder anaphylaktoide Reaktionen
Alle Arzneimittel, die wie FIBRYGA aus menschlichem Blut (das Eiweiße enthält) hergestellt und in eine Vene gespritzt werden (intravenöse Gabe), können allergische Reaktionen hervorrufen. Wenn Sie in der Vergangenheit allergische Reaktionen auf FIBRYGA gezeigt haben, wird Ihr Arzt Ihnen mitteilen, ob Sie Arzneimittel zum Schutz vor diesen Reaktionen benötigen.
Ihr Arzt wird Sie über Warnzeichen einer allergischen oder anaphylaktoiden Reaktion informieren.
Bitte achten Sie auf Frühzeichen einer allergischen Reaktion (Überempfindlichkeit) wie z. B.:
- Quaddeln
- Hautausschlag
- Engegefühl in der Brust
- Giemen
- niedrigen Blutdruck
- oder Anaphylaxie (wenn eines bis alle der oben erwähnten Symptome schnell auftreten und stark ausgeprägt sind).
Falls diese Beschwerden auftreten, muss die Injektion/Infusion von FIBRYGA sofort beendet werden (d. h. die Injektion abgebrochen werden).
Virussicherheit
Bei der Herstellung von Arzneimitteln aus menschlichem Blut oder Plasma werden bestimmte Maßnahmen getroffen, um zu vermeiden, dass Infektionen auf Patienten übertragen werden. Diese umfassen:
- die sorgfältige Auswahl der Spender von Blut und Plasma, um sicherzugehen, dass jene, die möglicherweise Infektionen haben, ausgeschlossen werden
- die Untersuchung aller Spenden und Plasmapools auf Anzeichen von Viren/Infektionen
- die Durchführung von Schritten zur Inaktivierung oder Entfernung von Viren bei der Verarbeitung des Blutes oder Plasmas.
Trotz dieser Maßnahmen kann bei Gabe von Arzneimitteln, die aus menschlichem Blut oder Plasma hergestellt wurden, die Möglichkeit der Übertragung von Infektionen nicht völlig ausgeschlossen werden. Dies gilt auch für unbekannte oder neu auftretende Viren und andere Infektionserreger.
Die getroffenen Maßnahmen werden für umhüllte Viren wie das humane Immunschwächevirus (HIV), das Hepatitis-B- und das Hepatitis-C-Virus sowie für das nicht umhüllte Hepatitis-A-Virus als wirksam angesehen. Die getroffenen Maßnahmen sind bei nicht umhüllten Viren wie dem Parvovirus B19 möglicherweise von begrenztem Wert.
Parvovirus-B19-Infektionen können für schwangere Frauen (Infektion des ungeborenen Kindes) und für Personen mit unterdrücktem Immunsystem oder mit bestimmten Arten von Blutarmut (Anämie, z. B. Sichelzellkrankheit oder ein gestörter Abbau der roten Blutkörperchen) schwerwiegende Folgen haben.
Es wird dringend empfohlen, dass jedes Mal, wenn Sie eine Dosis von FIBRYGA erhalten, der Name und die Chargenbezeichnung des Arzneimittels vermerkt werden, um Aufzeichnungen über die verwendeten Chargen zu haben.
Ihr Arzt wird Ihnen möglicherweise eine Impfung gegen Hepatitis A und B empfehlen, wenn Sie regelmäßig/wiederholt Fibrinogenprodukte erhalten, die aus humanem Plasma gewonnen wurden.
Kinder und Jugendliche
Für Kinder und Jugendliche gibt es keine spezifischen oder zusätzlichen Warnhinweise oder Vorsichtsmaßnahmen.
Anwendung von FIBRYGA zusammen mit anderen Arzneimitteln
Informieren Sie Ihren Arzt oder Apotheker wenn Sie andere Arzneimittel anwenden, kürzlich andere Arzneimittel angewendet haben oder beabsichtigen andere Arzneimittel anzuwenden.
FIBRYGA darf, außer mit den unter „Rekonstitution“ im Abschnitt „Die folgenden Informationen sind für medizinisches Fachpersonal bestimmt“ aufgeführten, nicht mit anderen Arzneimitteln gemischt werden.
Schwangerschaft, Stillzeit und Fortpflanzungsfähigkeit
Wenn Sie schwanger sind oder stillen, oder wenn Sie vermuten, schwanger zu sein oder beabsichtigen, schwanger zu werden, fragen Sie vor der Anwendung dieses Arzneimittels Ihren Arzt oder Apotheker um Rat. Dieses Arzneimittel darf während der Schwangerschaft und Stillzeit nur nach vorheriger Rücksprache mit Ihrem Arzt oder Apotheker angewendet werden.
Verkehrstüchtigkeit und Fähigkeit zum Bedienen von Maschinen
FIBRYGA hat keinen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
FIBRYGA enthält Natrium
Dieses Arzneimittel enthält bis zu 132 mg Natrium (Hauptbestandteil von Kochsalz) in jeder Flasche. Dies entspricht 6,6 % der für einen Erwachsenen empfohlenen maximalen täglichen Zufuhr von Natrium mit der Nahrung. Wenn Sie eine kochsalzarme Diät einhalten müssen, sollten Sie dies berücksichtigen.
3. Wie ist FIBRYGA anzuwenden?
Wenden Sie dieses Arzneimittel immer genau nach Absprache mit Ihrem Arzt an. Fragen Sie bei Ihrem Arzt nach, wenn Sie sich nicht sicher sind. FIBRYGA wird von medizinischem Fachpersonal als intravenöse Infusion (Infusion in eine Vene) gegeben.
Die Dosis und das Behandlungsschema sind von folgenden Faktoren abhängig:
- Ihrem Körpergewicht
- dem Schweregrad Ihrer Erkrankung
- dem Ort der Blutung oder
- der Art Ihrer Operation und
- Ihrem Gesundheitszustand
Anwendung bei Kindern und Jugendlichen
Die Gabe von FIBRYGA bei Kindern und Jugendlichen (intravenös) unterscheidet sich nicht von der Gabe bei Erwachsenen.
Wenn Sie eine größere Menge von FIBRYGA angewendet haben, als Sie sollten
Ihr Arzt wird Ihren Fibrinogenspiegel mit Bluttests regelmäßig überwachen, um das Risiko einer Überdosierung zu vermeiden.
Im Fall einer Überdosierung kann das Risiko für die Bildung von Blutgerinnseln in den Blutgefäßen erhöht sein.
Wenn Sie weitere Fragen zur Anwendung dieses Arzneimittels haben, wenden Sie sich an Ihren Arzt oder Apotheker.
Art der Anwendung
Dieses Arzneimittel ist zur Injektion oder Infusion in eine Vene nach Rekonstitution mit dem mitgelieferten Lösungsmittel bestimmt. Wenn Sie weitere Fragen zur Anwendung dieses Arzneimittels haben, wenden Sie sich an Ihren Arzt oder Apotheker.
4. Welche Nebenwirkungen sind möglich?
Wie alle Arzneimittel kann auch dieses Arzneimittel Nebenwirkungen haben, die aber nicht bei jedem auftreten müssen.
Wenden Sie sich sofort an Ihren Arzt,
- wenn eine der aufgeführten Nebenwirkungen bei Ihnen auftritt.
- wenn Sie Nebenwirkungen bemerken, die nicht in dieser Packungsbeilage angegeben sind.
Die folgenden Nebenwirkungen wurden von FIBRYGA und anderen Fibrinogenprodukten berichtet (die Häufigkeit der aufgeführten Nebenwirkungen ist nicht bekannt):
- Allergische oder anaphylaktoide Reaktionen: Hautreaktionen wie Hautausschlag oder Rötung der Haut (siehe Abschnitt 2, „Warnhinweise und Vorsichtsmaßnahmen“)
- Kardiovaskulär: Entzündung der Venen und Bildung von Blutgerinnseln, (siehe Abschnitt 2, „Warnhinweise und Vorsichtsmaßnahmen“)
- Anstieg der Körpertemperatur
- Wenn eine der oben genannten Beschwerden bei Ihnen auftritt, wenden Sie sich schnellstmöglich an Ihren Arzt.
Meldung von Nebenwirkungen
Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt oder Apotheker. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind. Sie können Nebenwirkungen auch direkt über das
Bundesamt für Sicherheit im Gesundheitswesen
Traisengasse 5
1200 WIEN
Fax: + 43 (0) 50 555 36207
Website: http://www.basg.gv.at/
anzeigen. Indem Sie Nebenwirkungen melden, können Sie dazu beitragen, dass mehr Informationen über die Sicherheit dieses Arzneimittels zur Verfügung gestellt werden.
5. Wie ist FIBRYGA aufzubewahren?
Bewahren Sie dieses Arzneimittel für Kinder unzugänglich auf.
Sie dürfen dieses Arzneimittel nach dem auf dem Etikett und dem Umkarton angegebenen Verfalldatum nicht mehr verwenden. Das Verfalldatum bezieht sich auf den letzten Tag des angegebenen Monats.
Nicht über 25 °C lagern. Nicht einfrieren. Die Flasche im Umkarton aufbewahren, um den Inhalt vor Licht zu schützen.
Das Pulver sollte erst unmittelbar vor der Injektion/Infusion aufgelöst werden. Die Stabilität der rekonstituierten Lösung wurde für 24 Stunden bei Raumtemperatur (max. 25 °C) gezeigt. Dessen ungeachtet sollte die Lösung sofort und nur einmalig angewendet werden, um Kontaminationen zu vermeiden. Das rekonstituierte Arzneimittel darf nicht im Kühlschrank oder Gefrierschrank gelagert werden.
Entsorgen Sie Arzneimittel nicht im Abwasser oder Haushaltsabfall. Fragen Sie Ihren Apotheker, wie das Arzneimittel zu entsorgen ist, wenn Sie es nicht mehr verwenden. Sie tragen damit zum Schutz der Umwelt bei.
6. Inhalt der Packung und weitere Informationen
Was FIBRYGA enthält
- Der Wirkstoff ist: humanes Fibrinogen.
- FIBRYGA enthält nach Rekonstitution mit dem mitgelieferten Lösungsmittel (50 mL Wasser für Injektionszwecke) 1 g humanes Fibrinogen pro Flasche bzw. 20 mg/mL humanes Fibrinogen.
- Die sonstigen Bestandteile sind: L-Argininhydrochlorid, Glycin, Natriumchlorid und Natriumcitrat-Dihydrat.
Wie FIBRYGA aussieht und Inhalt der Packung
FIBRYGA wird als Pulver und Lösungsmittel zur Herstellung einer Injektions-/Infusionslösung bereitgestellt und ist in Glasflaschen erhältlich.
Das Pulver ist weiß oder blassgelb und hygroskopisch, kann aber auch wie eine krümelige Masse aussehen.
Das Lösungsmittel ist eine klare und farblose Flüssigkeit.
Die rekonstituierte Lösung ist nahezu farblos und leicht opaleszierend.
FIBRYGA wird in einem Umkarton mit folgendem Inhalt verkauft:
- 1 Flasche mit Pulver zur Herstellung einer Injektions-/Infusionslösung
- 1 Fläschchen mit Lösungsmittel (Wasser für Injektionszwecke)
- 1 nextaro-Transfersystem
Pharmazeutischer Unternehmer
Octapharma Pharmazeutika Produktionsges.m.b.H.
Oberlaaer Straße 235, 1100 Wien, Österreich
Hersteller
Octapharma Pharmazeutika Produktionsges.m.b.H.
Oberlaaer Straße 235, 1100 Wien, Österreich
5Octapharma AB
Lars Forssells gata 23, 112 75 Stockholm, Schweden
Dieses Arzneimittel ist in den Mitgliedsstaaten des Europäischen Wirtschaftsraumes (EWR) und im Vereinigten Königreich (Nordirland) unter den folgenden Bezeichnungen zugelassen:
Fibryga®: Österreich, Belgien, Bulgarien, Dänemark, Deutschland, Estland, Finnland, Frankreich, Irland, Island, Italien, Kroatien, Lettland, Litauen, Luxemburg, Malta, Niederlande, Norwegen, Polen, Portugal, Rumänien, Schweden, Slowakei, Spanien, Tschechische Republik, Ungarn, Vereinigtes Königreich (Nordirland), Zypern
Fibrema®: Slowenien
Z.Nr.: 137788
Diese Packungsbeilage wurde zuletzt überarbeitet im 11/2023.
Anhang I – Anleitung zur Anwendung
Die folgenden Informationen sind für medizinisches Fachpersonal bestimmt:
Dosierung
Dosierung und Dauer der Substitutionstherapie hängen von der Schwere der Erkrankung, der Lokalisation und dem Umfang der Blutung sowie vom klinischen Zustand des Patienten ab. Die individuelle Dosierung sollte auf Grundlage des (funktionalen) Fibrinogenspiegels berechnet werden. Menge und Häufigkeit der Anwendung sollten individuell für den einzelnen Patienten durch regelmäßige Messung des Fibrinogenspiegels im Plasma und durch kontinuierliche Überwachung des klinischen Zustands des Patienten und anderer verwendeter Substitutionstherapien bestimmt werden. Bei größeren chirurgischen Eingriffen ist eine präzise Überwachung der Substitutionstherapie durch Gerinnungstests unbedingt erforderlich.
1. Prophylaxe bei Patienten mit kongenitaler Hypo- oder Afibrinogenämie und bekannter Blutungsneigung
Um übermäßige Blutungen bei chirurgischen Eingriffen zu verhindern, wird eine prophylaktische Behandlung empfohlen, um den Fibrinogenspiegel auf 1 g/L anzuheben und auf diesem Wert zu halten, bis die Hämostase unter Kontrolle ist, und auf über 0,5 g/L zu halten, bis die Wundheilung abgeschlossen ist. Für einen chirurgischen Eingriff oder zur Behandlung einer Blutungsepisode sollte die Dosis wie folgt berechnet werden:
Dosis (mg/kg Körpergewicht) = (Zielspiegel [g/L] – gemessener Spiegel [g/L]) : 0,018 (g/L pro mg/kg Körpergewicht)
Die nachfolgende Dosierung (Injektionsdosen und -häufigkeit) sollte auf Grundlage des klinischen Zustands des Patienten und der Laborergebnisse erfolgen. Die biologische Halbwertszeit von Fibrinogen beträgt 3 – 4 Tage. Daher ist bei fehlendem Verbrauch eine wiederholte Behandlung mit humanem Fibrinogen in der Regel nicht erforderlich. Aufgrund der Akkumulation bei wiederholter Verabreichung zur Prophylaxe sollten die Dosis und Häufigkeit der Gabe auf Grundlage der therapeutischen Ziele des Arztes für den jeweiligen Patienten bestimmt werden.
Kinder und Jugendliche
Für einen chirurgischen Eingriff oder zur Behandlung einer Blutungsepisode sollte die Dosis für Jugendliche gemäß der vorstehend beschriebenen Formel für Erwachsene berechnet werden, während die Dosis für Kinder unter 12 Jahren wie folgt zu berechnen ist:
Dosis (mg/kg Körpergewicht) = (Zielspiegel [g/L] – gemessener Spiegel [g/L]) : 0,014 (g/L pro mg/kg Körpergewicht)
Die nachfolgende Dosierung sollte auf Grundlage des klinischen Zustands des Patienten und der Laborergebnisse erfolgen.
Ältere Patienten
In klinischen Studien mit FIBRYGA waren keine Patienten ab 65 Jahren eingeschlossen, so dass keine endgültige Aussage darüber gemacht werden kann, ob diese Patienten anders auf die Behandlung ansprechen als jüngere Patienten.
2. Behandlung von Blutungen
Blutungen bei Patienten mit kongenitaler Hypo- oder Afibrinogenämie
Blutungsepisoden sollten gemäß den vorstehenden Formeln für Erwachsene/Jugendliche bzw. Kinder behandelt werden, um den Fibrinogenspiegel im Plasma auf den empfohlenen Zielwert von 1 g/L anzuheben. Der Fibrinogenspiegel sollte auf diesem Wert gehalten werden, bis die Hämostase unter Kontrolle ist.
Blutungen bei Patienten mit erworbenem Fibrinogenmangel Erwachsene
Im Allgemeinen werden initial 1-2 g verabreicht mit nachfolgenden Infusionen nach Bedarf. Bei schwerwiegenden Blutungen z.B. bei größeren Operationen, können größere Mengen an Fibrinogen (4-8 g) erforderlich sein.
Kinder und Jugendliche
Die Dosierung sollte nach dem Körpergewicht und der klinischen Notwendigkeit bestimmt werden, beträgt aber normalerweise 20-30 mg/kg.
Hinweise zur Zubereitung und Anwendung
Allgemeine Hinweise
- Die rekonstituierte Lösung sollte nahezu farblos und leicht opaleszierend sein. Keine Lösungen verwenden, die trübe sind oder Ablagerungen aufweisen.
- FIBRYGA ist nur zur einmaligen Verwendung bestimmt. Kein Bestandteil darf erneut verwendet werden.
- Aus Gründen der mikrobiologischen Sicherheit sollte das Arzneimittel sofort nach der Rekonstitution verwendet werden. Die chemische und physikalische Stabilität nach Rekonstitution wurde für 24 Stunden bei Raumtemperatur (max. 25° C) gezeigt. Die rekonstituierte Lösung darf nicht eingefroren oder im Kühlschrank gelagert werden.
Rekonstitution
1. Stellen Sie sicher, dass die Flasche mit dem Pulver (FIBRYGA) und das Fläschchen mit dem Lösungsmittel Raumtemperatur aufweisen. Diese Temperatur sollte während der Rekonstitution beibehalten werden. Wenn zum Aufwärmen ein Wasserbad benutzt wird, muss darauf geachtet werden, dass das Wasser nicht in Kontakt mit den Gummistopfen oder den Verschlusskappen der Behältnisse kommt. Die Temperatur des Wasserbads sollte +37 °C nicht überschreiten.
2. Die Verschlusskappen von der Flasche mit dem Pulver (FIBRYGA) und dem Fläschchen mit dem Lösungsmittel abziehen, um den zentralen Teil des Infusionsstopfens freizulegen. Die Gummistopfen mit einem Alkoholtupfer säubern und anschließend trocknen lassen.
3. Die Packung mit dem Transfersystem (nextaro) durch Abziehen des Deckels öffnen (Abb. 1). Das Transfersystem nicht aus der durchsichtigen Blisterpackung nehmen, um die Sterilität zu gewährleisten. Nicht den Dorn berühren.
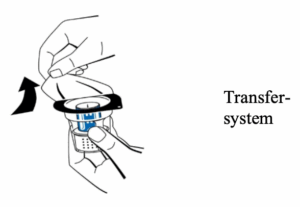
4. Das Fläschchen mit dem Lösungsmittel auf eine ebene, saubere Fläche stellen und festhalten. Ohne die Blisterpackung zu entfernen, den blauen Teil des Transfersystems auf das Fläschchen mit dem Lösungsmittel aufsetzen. Gerade und fest nach unten drücken, bis es einrastet (Abb. 2). Beim Aufsetzen nicht drehen.
Hinweis:
Das Transfersystem muss zuerst auf das Fläschchen mit dem Lösungsmittel und dann auf die Flasche mit dem lyophilisierten Pulver aufgesetzt werden. Andernfalls kommt es zu einem Verlust des Vakuums, und das Lösungsmittel kann nicht überführt werden.
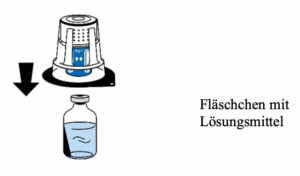
5. Das Fläschchen mit dem Lösungsmittel festhalten und die Blisterpackung vorsichtig vom Transfersystem (nextaro) entfernen, indem Sie diese senkrecht nach oben ziehen. Achten Sie darauf, dass das Transfersystem fest mit dem Fläschchen mit dem Lösungsmittel verbunden bleibt (Abb. 3).
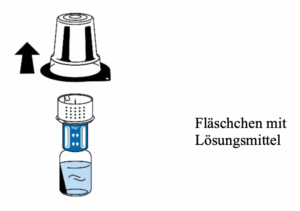
6. Die Flasche mit dem Pulver (FIBRYGA) auf eine ebene, saubere Fläche stellen und festhalten. Das Fläschchen mit dem Lösungsmittel und dem daran befestigten Transfersystem ergreifen und auf den Kopf drehen. Den weißen Teil des Transfersystem-Verbindungsstücks auf die Flasche mit dem Pulver (FIBRYGA) setzen und fest nach unten drücken, bis es einrastet (Abb. 4). Beim Aufsetzen nicht drehen. Das Lösungsmittel fließt automatisch in die Flasche mit dem Pulver (FIBRYGA).
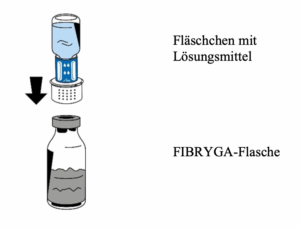
7. Die FIBRYGA -Flasche mit dem daran befestigten Fläschchen mit dem Lösungsmittel vorsichtig schwenken, bis das Pulver vollständig gelöst ist. Die Flasche nicht schütteln, um Schaumbildung zu vermeiden. Das Pulver sollte innerhalb von ca. 5 Minuten vollständig gelöst sein. Das Auflösen des Pulvers sollte nicht länger als 20 Minuten dauern. Wenn das Pulver nach 20 Minuten noch nicht vollständig gelöst ist, muss das Arzneimittel verworfen werden.
8. In den seltenen Fällen, in denen während der Überführung des WfI ein in der Flüssigkeit schwimmendes, nicht rekonstituiertes Pulver festgestellt wird oder die Rekonstitution unerwartet lange dauert, kann der Auflösungsprozess durch kräftigere horizontale Bewegung der Flasche unterstützt werden.
9. Nach Abschluss der Rekonstitution das Transfersystem (blauer Teil) gegen den Uhrzeigersinn in zwei Teile aufdrehen (Abb. 5). Dabei den Luer-Lock-Anschluss am weißen Teil des Transfersystems nicht berühren.
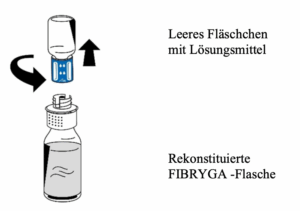
10. Das leere Lösungsmittel-Fläschchen zusammen mit dem blauen Teil des Transfersystems entsorgen.
Anwendung
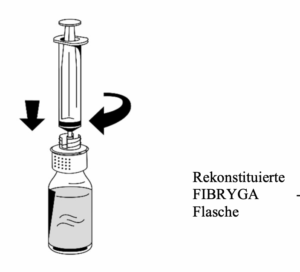
1. Vorsichtig eine Spritze am Luer-Lock-Anschluss auf dem weißen Teil des Transfersystems anbringen (Abb. 6).
2. Die FIBRYGA -Flasche auf den Kopf drehen und die Lösung in die Spritze aufziehen (Abb. 7).
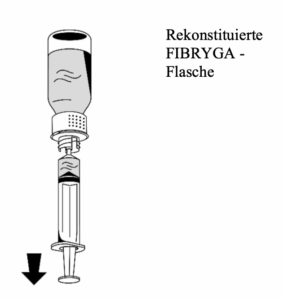
3. Nachdem die Lösung aufgezogen wurde, den Spritzenkörper festhalten (der Spritzenkolben zeigt nach unten) und die Spritze vom Transfersystem trennen (Abb. 8).
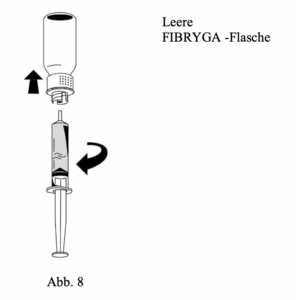
4. Den weißen Teil des Transfersystems zusammen mit der leeren FIBRYGA-Flasche entsorgen.
Zur intravenösen Verabreichung der rekonstituierten Lösung bei Raumtemperatur wird die Verwendung eines herkömmlichen Infusionssets empfohlen.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
Art der Anwendung
Intravenöse Infusion oder Injektion.
FIBRYGA sollte als langsame intravenöse Infusion mit einer empfohlenen maximalen Infusionsgeschwindigkeit von 5 mL/min verabreicht werden bei Patienten mit kongenitaler Hypo- oder Afibrinogenämie und mit einer empfohlenen maximalen Infusionsgeschwindigkeit von 10 mL/min bei Patienten mit erworbenem Fibrinogenmangel.
Inkompatibilitäten
Das Arzneimittel darf nicht mit anderen Arzneimitteln gemischt werden.